
A la pregunta “¿Cuál es el animal más usado en un laboratorio?” mucha gente responde sin dudar “¡El ratón!”. Quizá mencionen a la cobaya, ratas, cerdos o incluso moscas de la fruta, pero lo que muy poca gente sabe es que el pez cebra también se cuela en esta lista de modelos animales en laboratorio.
Las razones son varias: son pequeños, fáciles de mantener, se reproducen y desarrollan muy rápido y son fácilmente modificables a nivel genético. Pero hay dos motivos que hacen del pez cebra un excelente candidato para la investigación cardiovascular: son capaces de vivir sin latido cardiaco hasta 7 días postfertilización (es decir, tras la unión de los gametos masculino y femenino) y su corazón es capaz de regenerarse tras una lesión de miocardio (el principal tejido del corazón).
Es esta última característica la que lleva al grupo de Nadia Mercader, profesora visitante en el Centro Nacional de Investigaciones Cardiovasculares (CNIC) y jefa del Departamento de Anatomía de la Universidad de Berna (Suiza), a investigar los mecanismos celulares por los que el pez cebra es capaz de regenerar su corazón, una habilidad que los humanos perdimos evolutivamente hace miles de años y que, de ser recuperada, ayudaría a combatir el infarto de miocardio y otras enfermedades congénitas del corazón.
Aunque la idea parezca un poco peregrina a primera vista, los resultados indican que cada vez estamos más cerca de conseguirlo. El corazón del pez cebra tiene las mismas capas que las de un humano, y su desarrollo embrionario también es muy similar.
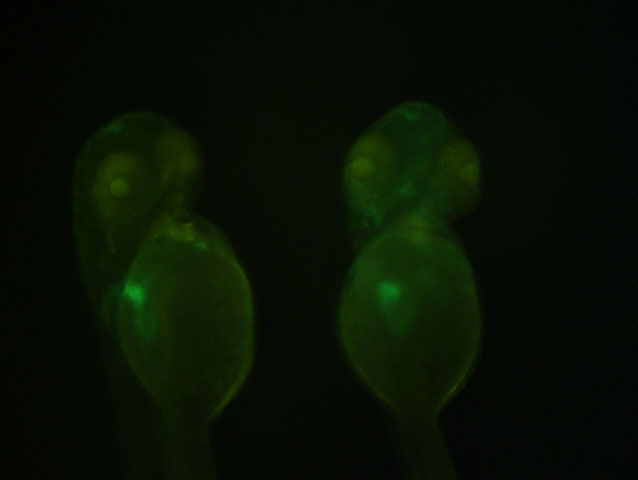
Una estructura clave en la regeneración del miocardio es el epicardio, una capa protectora del corazón. Cuando se produce una lesión en el miocardio, esta capa en estado latente se “reactiva” y empieza a emitir unos mensajeros químicos que son detectados por el miocardio para empezar a regenerar el corazón. Por tanto, estudiar cómo se desarrolla en el embrión el epicardio ayuda a entender cuáles son esos mensajeros químicos que primeramente activan al epicardio, y que desencadenan el proceso de regeneración cardiaca.
El origen embrionario del epicardio está en una estructura más pequeña, el proepicardio. El proepicardio no es más que un pequeño grupo de células amontonadas que nacen en el saco pericárdico, una estructura que envuelve el corazón y lo separa del resto del cuerpo, a la vez que lo protege. Entre el corazón y las paredes del saco hay un líquido (fluido pericárdico) que ayuda a lubricar y a reducir la fricción de los latidos del corazón sobre las paredes del saco pericárdico. En una de las paredes de este saco, a unas 55 horas postfertilización, algunas células empiezan a juntarse hasta dar lugar al proepicardio. Después, estas células se sueltan debido al movimiento del fluido pericárdico hasta que se adhieren a la pared del corazón, y empiezan a dividirse hasta cubrir completamente el corazón y formar así el epicardio.

Pero, ¿cómo se forma el proepicardio?
En este trabajo se combinó el uso de herramientas genéticas, técnicas de microscopía in vivo (el embrión permanecía vivo durante todo el proceso de captura de imágenes) y herramientas matemáticas para resolver esta pregunta.
Se tomaron imágenes confocales (en 3 dimensiones) del proceso de desarrollo del proepicardio en varios intervalos de tiempo, obteniendo así vídeos en 3 dimensiones. Los embriones fueron modificados genéticamente para hacer visibles (verde fluorescente) las células del saco pericárdico al microscopio.
La primera observación de estos vídeos en 3D fue el cambio de la trayectoria de estas células en distintos escenarios: Las células del saco pericárdico que dan lugar al proepicardio no se movían de la misma manera en función de distintas drogas o sobreexpresión de mensajeros químicos, de forma que la pared del saco se deformaba de maneras distintas.
Para poder cuantificar esos cambios se ha desarrollado un software que calcula la divergencia del campo de velocidades del tejido. Puesto de una manera simple, lo que hace el software es coger las trayectorias de todas las células de la pared del saco (unas 60-80 células aproximadamente) y sus respectivas velocidades y lo convierte en un mapa de color donde se observa qué parte de la pared del saco se está expandiendo o contrayendo, y con cuánta intensidad lo hace (se ve si unas partes se expanden más que otras). Al repetir el proceso para todos los tiempos del video se obtiene un mapa de color interactivo donde se observa la expansión/constricción de la pared del saco en 3D cambiando a lo largo del tiempo.
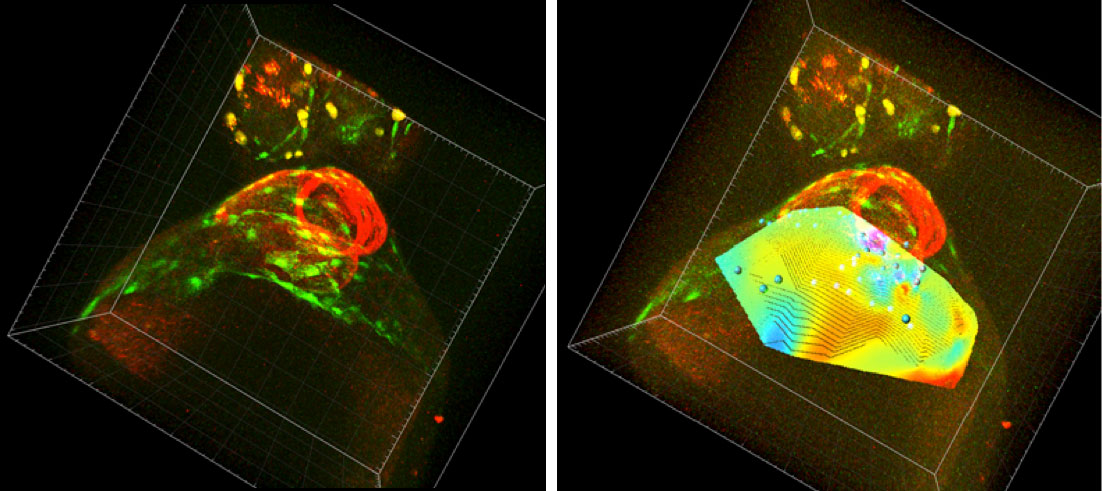
Figura 1a. Embrión de pez cebra. En verde se muestran las células del saco pericárdico y en rojo el corazón. Figura 1b. Embrión de pez cebra con el canal de la divergencia del campo de velocidades acoplado. Colores naranjas/rojos indican una expansión del saco, azules una constricción.
Gracias a esta herramienta se ha podido comprobar que, en condiciones normales, esta pared del saco pericárdico realiza una constricción hacia una zona llamada “línea media”, que coincide con la zona de aparición del proepicardio.
Para investigar las causas de dicha constricción se inhibió la miosina II de las células del saco pericárdico. La miosina II es una proteína del citoesqueleto, una red intrincada de proteínas que sustentan a la célula y le confieren estabilidad mecánica (algo parecido a nuestros huesos y músculos). Los resultados indicaron que, cuando se alteraba este citoesqueleto, las células de la pared del saco pericárdico no eran capaces de realizar la constricción que se observa en condiciones normales. Por el contrario, en vez de observar la constricción hacia la línea media, las células se separaban cada vez más, haciendo que el tejido se expandiera y no se formase el proepicardio.
El siguiente paso fue investigar si la inhibición de la miosina II – alteración del citoesqueleto – podía ser contrarrestada con otros mensajeros químicos para entender mejor este proceso. En el citoesqueleto, al ser una red tan entramada de mensajeros químicos donde unos activan/desactivan a otros, es muy difícil encontrar una secuencia específica de activación/desactivación entre ellos.
Para ello se sobreexpresó BMP2 (Proteína morfogenética de hueso-2 o Bone morphogenetic protein en inglés), uno de esos “mensajeros químicos” encontrados en el desarrollo del corazón. Al sobreexpresarlo en presencia de miosina II inhibida, la constricción de la pared del saco pericárdico recuperó valores más cercanos a los encontrados en desarrollos normales, indicando que BMP2 juega un papel importante en el desarrollo del proepicardio.
Los futuros pasos en el proyecto serán un estudio más exhaustivo de diferentes mensajeros químicos encontrados en el desarrollo del corazón, para comprender cuál es la secuencia específica que lleva a la formación del proepicardio, y por tanto, poder activarla en escenarios donde sea necesaria la regeneración del corazón.
Este trabajo fue supervisado por Laura Andrés-Delgado, investigadora postdoctoral del grupo de Nadia Mercader, y fue presentado como Tesis de Fin de Grado en el Grado de Ingeniería Biomédica de la Universidad Carlos III de Madrid. Fue clasificado como finalista en el certamen “Arquímedes” donde recibió un accésit.

AUTOR
David Bazaga.
Premio «Accesit» en el XV Certamen Universitario Arquímedes por el trabajo «Estudio de la formación del Proepicardio en pez cebra realizado por David Bazaga García (Universidad Carlos III de Madrid) y tutorizado por Nadia Mercader Huber.
+INFO CERTAMEN ARQUÍMEDES
Web del certamen | Facebook





No comments yet.