
A la pregunta “Quin és l’animal més usat en un laboratori?”, molta gent respon sense dubtar “El ratolí!”. Potser mencionen el conillet d’Índies, les rates, els porcs o fins i tot les mosques de la fruita; però el que molt poca gent sap és que el peix zebra també es cola en aquesta llista de models animals en laboratori.
Les raons són diverses: són menuts, fàcils de mantenir, es reprodueixen i es desenvolupen molt ràpidament, i són fàcilment modificables a nivell genètic. Però hi ha dos motius que fan del peix zebra un excel·lent candidat per a la investigació cardiovascular: són capaços de viure sense batec cardíac fins a set dies postfertilizació (és a dir, després de la unió dels gàmetes masculí i femení) i el seu cor és capaç de regenerar-se després d’una lesió de miocardi (el principal teixit del cor).
És aquesta última característica la que porta el grup de Nadia Mercader, professora visitant en el Centre Nacional d’Investigacions Cardiovasculars (CNIC) i cap del Departament d’Anatomia de la Universitat de Berna (Suïssa), a investigar els mecanismes cel·lulars pels quals el peix zebra és capaç de regenerar el cor, una habilitat que els humans vam perdre evolutivament fa milers d’anys, i que, si es recuperara, ajudaria a combatre l’infart de miocardi i altres malalties congènites del cor.
Encara que la idea parega un poc peregrina a primera vista, els resultats indiquen que cada vegada estem més prop d’aconseguir-ho. El cor del peix zebra té les mateixes capes que les d’un humà, i el seu desenvolupament embrionari també és molt similar.
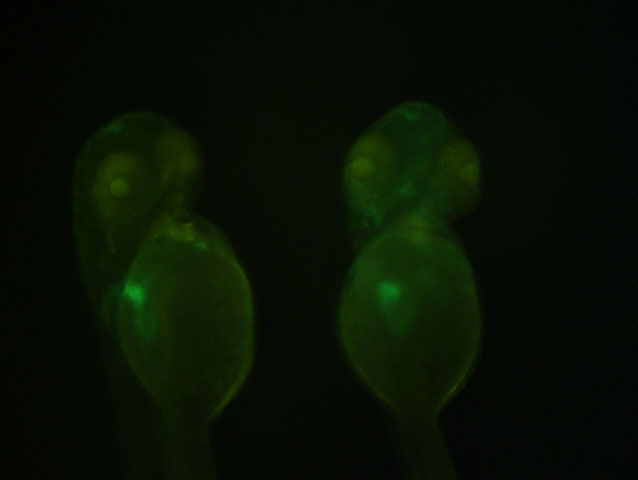
Una estructura clau en la regeneració del miocardi és l’epicardi, una capa protectora del cor. Quan es produeix una lesió en el miocardi, aquesta capa en estat latent es “reactiva” i comença a emetre uns missatgers químics que són detectats pel miocardi per a començar a regenerar el cor. Per tant, estudiar com es desenvolupa en l’embrió l’epicardi ajuda a entendre quins són aquests missatgers químics que primerament activen l’epicardi, i que desencadenen el procés de regeneració cardíaca.
L’origen embrionari de l’epicardi està en una estructura més xicoteta, el proepicardi. El proepicardi no és més que un reduït grup de cèl·lules amuntonades que naixen en el sac pericàrdic, una estructura que embolcalla el cor i el separa de la resta del cos, alhora que el protegeix. Entre el cor i les parets del sac hi ha un líquid (fluid pericàrdic) que ajuda a lubricar i a reduir la fricció dels batecs del cor sobre les parets del sac pericàrdic. En una de les parets d’aquest sac, a unes 55 hores postfertilizació, algunes cèl·lules comencen a ajuntar-se fins a donar lloc al proepicardi. Després, aquestes cèl·lules se solten a causa del moviment del fluid pericàrdic fins que s’adhereixen a la paret del cor, i comencen a dividir-se fins a cobrir completament el cor i formar així l’epicardi.

Però com es forma el proepicardi?
En aquest treball es va combinar l’ús de ferramentes genètiques, tècniques de microscopia in vivo (l’embrió es mantenia viu durant tot el procés de captura d’imatges) i ferramentes matemàtiques per a resoldre aquesta pregunta.
Es van prendre imatges confocals (en tres dimensions) del procés de desenvolupament del proepicardi en diversos intervals de temps, i es van obtenir així vídeos en tres dimensions. Els embrions van ser modificats genèticament per a fer visibles (verd fluorescent) les cèl·lules del sac pericàrdic al microscopi.
La primera observació d’aquests vídeos en 3D va ser el canvi de la trajectòria d’aquestes cèl·lules en distints escenaris: les cèl·lules del sac pericàrdic que donen lloc al proepicardi no es movien de la mateixa manera en funció de distintes drogues o sobreexpressió de missatgers químics, de manera que la paret del sac es deformava de maneres distintes.
Per a poder quantificar aquests canvis, s’ha desenvolupat un programari que calcula la divergència del camp de velocitats del teixit. Dit d’una manera simple, el que fa el programari és agafar les trajectòries de totes les cèl·lules de la paret del sac (unes 60-80 cèl·lules aproximadament) i les seues respectives velocitats i ho converteix en un mapa de color on s’observa quina part de la paret del sac s’està expandint o contraient, i amb quina intensitat ho fa (es veu si unes parts s’expandeixen més que altres). En repetir el procés per a tots els temps del vídeo, s’obté un mapa de color interactiu on s’observa l’expansió/constricció de la paret del sac en 3D que canvia al llarg del temps.
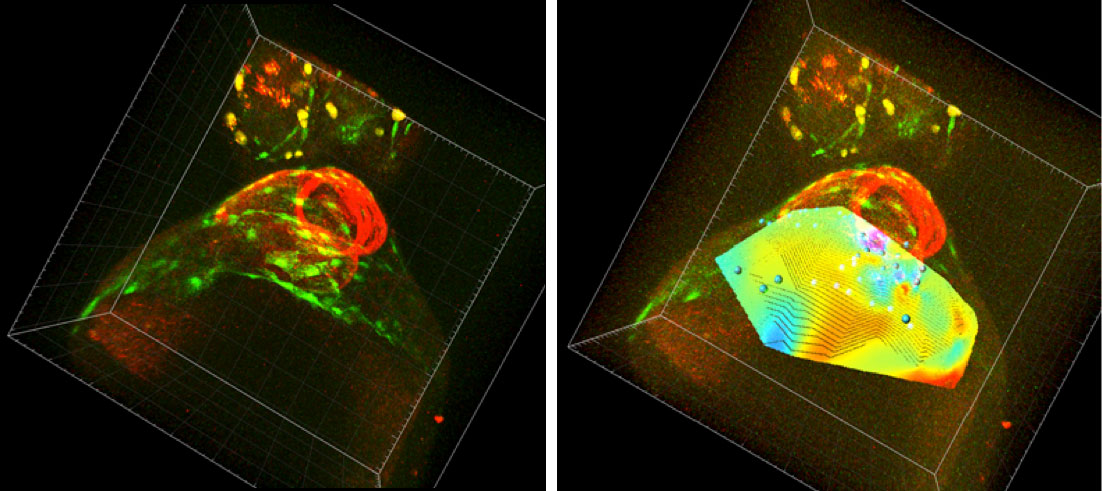
Figura 1a. Embrió de peix zebra. En verd es mostren les cèl·lules del sac pericàrdic, i en roig, el cor. Figura 1b. Embrió de peix zebra amb el canal de la divergència del camp de velocitats adaptat. Colors taronja/rojos indiquen una expansió del sac, blaus una constricció.
Gràcies a aquesta ferramenta s’ha pogut comprovar que, en condicions normals, aquesta paret del sac pericàrdic fa una constricció cap a una zona anomenada línia mitjana, que coincideix amb la zona d’aparició del proepicardi.
Per a investigar les causes d’aquesta constricció es va inhibir la miosina II de les cèl·lules del sac pericàrdic. La miosina II és una proteïna del citoesquelet, una xarxa intricada de proteïnes que sustenten la cèl·lula i li confereixen estabilitat mecànica (una cosa semblant als nostres ossos i músculs). Els resultats van indicar que, quan s’alterava aquest citoesquelet, les cèl·lules de la paret del sac pericàrdic no eren capaces de fer la constricció que s’observa en condicions normals. Al contrari, en compte d’observar la constricció cap a la línia mitjana, les cèl·lules se separaven cada vegada més, fent que el teixit s’expandira i no es formara el proepicardi.
El pas següent va ser investigar si la inhibició de la miosina II –alteració del citoesquelet– podia ser contrarestada amb altres missatgers químics per a entendre millor aquest procés. En el citoesquelet, com que és una xarxa tan entramada de missatgers químics on uns activen/desactiven uns altres, és molt difícil trobar una seqüència específica d’activació/desactivació entre ells.
Per a això se sobreexpressà BMP2 (proteïna morfogenètica d’os-2 o Bone morphogenetic protein en anglés), un d’aquests “missatgers químics” trobats en el desenvolupament del cor. En sobreexpressar-lo en presència de miosina II inhibida, la constricció de la paret del sac pericàrdic va recuperar valors més pròxims als trobats en desenvolupaments normals, la qual cosa indica que BMP2 té un paper important en el desenvolupament del proepicardi.
Els futurs passos en el projecte seran un estudi més exhaustiu de diferents missatgers químics trobats en el desenvolupament del cor per a comprendre quina és la seqüència específica que porta a la formació del proepicardi, i per tant poder activar-la en escenaris on siga necessària la regeneració del cor.
Aquest treball va ser supervisat per Laura Andrés-Delgado, investigadora postdoctoral del grup de Nadia Mercader, i va ser presentat com a tesi de fi de grau en el Grau d’Enginyeria Biomèdica de la Universitat Carles III de Madrid. Va ser classificat com a finalista en el certamen “Arquímedes”, on va rebre un accèssit.

AUTOR
David Bazaga.
Premio “Accesit” en el XV Certamen Universitario Arquímedes por el trabajo “Estudio de la formación del Proepicardio en pez cebra realizado por David Bazaga García (Universidad Carlos III de Madrid) y tutorizado por Nadia Mercader Huber.
+INFO CERTAMEN ARQUÍMEDES
Web del certamen | Facebook





No comments yet.