Podran algun dia els metges utilitzar trepants diminuts per a foradar i destruir les cèl·lules del càncer? El passat mes d’agost la revista Nature va publicar una investigació que podria representar el primer pas ferm cap aquest escenari. En l’estudi, científics d’universitats nord-americanes i del Regne Unit van aconseguir perforar –iniciant la seua mort– cèl·lules d’un càncer de pròstata cultivades in vitro.

El xip prodigiós: una pel·lícula produïda per Steven Spielberg on les màquines miniaturitzades tenen un paper protagonista.
Salvant les diferències, l’escenari té elements en comú amb les profecies d’alguns grans clàssics de la ciència-ficció. Les nanomàquines porten de seguida a la ment pel·lícules com El xip prodigiós (1987), l’argument del qual, per cert, segueix els mateixos passos d’una pel·lícula anterior, Viatge fantàstic (1966) –en el guió dels quals, al seu torn, es va basar la novel·la d’Isaac Asimov del mateix nom: dècada dels seixanta, plena Guerra Freda; els personatges de la trama protagonitzen el primer experiment de miniaturització de la història per a intentar salvar un científic soviètic que ha desertat cap als Estats Units. A bord d’un submarí miniaturitzat i de la grandària d’un bacteri, els protagonistes són introduïts en el sistema circulatori del científic soviètic, amb la missió de viatjar fins al seu cervell per a trobar i destruir una trombosi que amenaça la vida del científic.
Una cosa semblant podríem imaginar en un futur per als nanotrepants que enguany han desenvolupat els científics en l’estudi publicat en Nature. Però això és encara ciència-ficció, i també hi ha diferències importants amb aquesta investigació. En aquest cas, la màquina miniaturitzada no portava tripulants; i tampoc tractava d’eliminar una obstrucció en el sistema circulatori causada per una trombosi. Ara per ara, els científics només han aconseguit destruir cèl·lules cancerígenes cultivades al laboratori.
Un motor elèctric a nanoescala
Els científics van utilitzar un mètode de síntesi química per a fabricar unes diminutes màquines moleculars de tot just un nanòmetre de longitud –50.000 vegades més xicotetes que el gruix d’un cabell humà. Aquests dispositius no s’assemblen a cap màquina que puguem veure a simple vista, i així i tot el seu comportament recorda el d’un motor elèctric. D’una banda, aquests nanotrepants tenen una part estàtica que fa de bastida (subjectant tota l’estructura i fixant-la en un lloc determinat, com la membrana d’una cèl·lula) i un rotor mòbil amb forma de pala. El rotor, que no és una altra cosa que tres anells químics formats per àtoms de carboni, gira a una velocitat de vertigen –entre 2 i 3 milions de vegades per segon–, aplicant una força tangencial d’uns cinc-cents mN m-1 (mil·linewtons/metre), quasi vint vegades superior a la tensió màxima que pot suportar una bicapa lipídica com les que envolten les cèl·lules. Amb aquests números, els científics van pensar que els nanotrepants bé podrien foradar la membrana d’una cèl·lula i d’aquesta manera iniciar la mort cel·lular, ja que les cèl·lules necessiten mantenir les membranes estanques per a sobreviure. Podrien llavors emprar-se els nanotrepants amb un fi terapèutic –per a destruir cèl·lules danyoses com les cèl·lules tumorals?
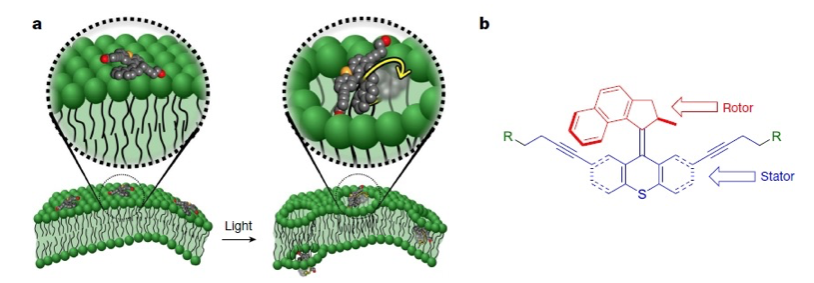
Forma d’actuació i estructura química dels nanotrepants. Els nanotrepants s’adhereixen a la membrana lipídica, la qual perforen quan són activats per il·luminació amb llum ultravioleta. L’estructura química consta d’una part giratòria (rotor) i una part fixa que assembla el conjunt.
Abans, els científics havien de comprovar si, efectivament, els nanotrepants eren capaços de destruir cèl·lules. Però abans d’això, els científics van equipar els seus nanodispositius amb un interruptor –de poc serviria un trepant que estiguera sempre encés (seria fins i tot perillós). En aquest cas, l’interruptor actuava gràcies a la llum ultravioleta. Quan llum d’una longitud d’ona d’entre 355 i 365 nanòmetres incidia sobre el nanotrepant, la pala girava sobre l’enllaç químic que uneix el rotor a la part estàtica. Al seu torn, la nova forma girada (denominada isòmer) es veia sotmesa al mateix procés químic quan la llum hi incidia: l’enllaç tornava a girar fins a produir de nou la forma molecular inicial. Com que el gir d’aquest enllaç era sempre unidireccional, la pala del rotor efectivament girava 360 graus una vegada i una altra mentre fóra irradiat amb llum d’aquestes característiques. Així és com aquestes màquines moleculars es comportaven com un trepant activable a voluntat amb llum ultravioleta.
Nanotrepants que perforen membranes
En un primer experiment, els científics van comprovar que efectivament aquests nanotrepants eren capaços de foradar una membrana lipídica. Per a això, van utilitzar unes xicotetes esferes similars a les micel·les que es formen en mesclar oli i aigua. En aquest cas, les esferes estaven fetes d’una bicapa de lípids (com cèl·lules en miniatura) i encloïen unes molècules fluorescents junt amb els nanotrepants. D’aquesta manera, en activar els nanotrepants amb llum ultravioleta, es produïen forats en la membrana de les esferes per on escapaven les molècules fluorescents. Amb un microscopi, els científics van observar que la fluorescència es desplaçava des de dins cap a fora de les esferes. Això indicava que el nanotrepant funcionava, almenys en aquest sistema simplificat.

Nou micel·les fluorescents carregades amb nanotrepants i molècules fluorescents s’observen al microscopi com taques de llum amb forma més o menys esfèrica. Una vegada comença a il·luminar-se amb llum ultravioleta, la intensitat de la fluorescència en totes les esferes disminueix gradualment al llarg del temps, pel fet que la molècula fluorescent ix a l’exterior a través dels forats creats pels nanotrepants (en un experiment control sense nanotrepants, la fluorescència no canvia).
El següent pas va ser comprovar el potencial destructor dels nanotrepants en cèl·lules reals. Per a això, els científics van alliberar aquestes nanomàquines en cèl·lules tumorals (derivades d’un càncer de pròstata). En aquest experiment, després d’il·luminar les cèl·lules amb llum ultravioleta, les cèl·lules mostraven signes clars de necrosi (per exemple, arrugues en la membrana) després d’aproximadament 150 segons (2 minuts i mig) de l’inici de la irradiació. La llum ultravioleta, quan s’exposa ininterrompudament, acaba matant les cèl·lules de totes maneres, però en un període de temps molt més gran (els signes de necrosi apareixen després d’aproximadament 5 minuts; és a dir, amb nanotrepants apareixen un 50% més ràpid) en aquestes mateixes cèl·lules. Aquesta diferència indicava que els nanotrepants eren capaços d’iniciar la destrucció de les cèl·lules.
També és molt important, abans d’irradiar amb llum, que les cèl·lules no mostraven signes de toxicitat, cosa que indicaria que els nanotrepants inactius no són per si mateixos danyosos per a les cèl·lules –una observació que serà vital corroborar abans que puguen algun dia utilitzar-se en organismes complets (animals o persones).
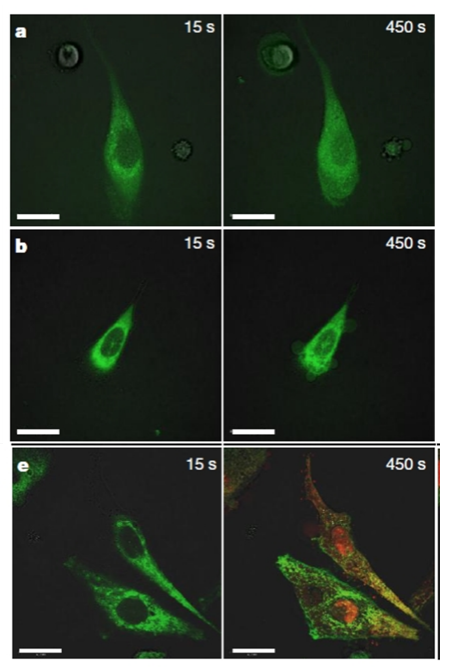
Necrosi de cèl·lules tumorals per acció dels nanotrepants. En la fila superior s’observa un experiment control on la cèl·lula es mostra saludable després de 15 o 450 segons d’il·luminació amb llum ultravioleta. En la segona fila, els nanotrepants han sigut afegits, i la cèl·lula mostra arrugues (senyal de necrosi) després del mateix període de temps. Baix, s’ha afegit, a més dels nanotrepants, un marcador fluorescent de color roig que tiny l’ADN i l’ARN (localitzats principalment, en el nucli cel·lular). En condicions normals, aquest marcador no és capaç d’entrar en la cèl·lula. Després de 450 segons d’il·luminació amb llum ultravioleta, l’aparició dins de la cèl·lula de color roig (i també groc per la mescla de roig i verd) indica que s’han produït forats en la membrana cel·lular per on ha entrat el marcador (en un assaig control sense nanotrepants, no apareixen els colors roig ni groc després del mateix període de temps).
Nanotrepants amb codi postal
Un punt essencial perquè una teràpia contra el càncer siga efectiva és poder atacar només aquestes cèl·lules mentre es preserven intactes les cèl·lules veïnes que no són canceroses. Per això, els científics van provar a afegir als nanotrepants unes molècules que, a manera de codis postals, pogueren dirigir l’atac a certes cèl·lules. En aquest cas, van afegir unes molècules que s’adhereixen a una proteïna localitzada exclusivament en la superfície de les cèl·lules d’un càncer de pròstata, la qual cosa hauria de restringir l’acció del nanotrepant a aquesta cèl·lula en particular. Per a comprovar-ho, els científics van afegir aquests nanotrepants amb codis de barres a les cèl·lules tumorals i també a altres cèl·lules no tumorals per a comparar.
El resultat, novament, va mostrar que els nanotrepants promovien la mort de les cèl·lules tumorals, les quals començaven a mostrar necrosi a partir de 150-210 segons d’irradiació amb llum ultravioleta (un 28-37% més ràpid que sense nanotrepants). Les cèl·lules no tumorals, no obstant això, van començar a mostrar aquests signes a partir de 270-300 segons (un 3-5 % més ràpid que sense nanotrepants). És a dir, els nanotrepants van actuar amb més eficàcia sobre les cèl·lules tumorals, encara que també van tenir un lleuger efecte residual sobre les altres cèl·lules no tumorals.
Aquestes troballes apunten un futur prometedor per als nanotrepants com a ferramenta contra el càncer, tot i que encara queda molt a aclarir i refinar. D’una banda, cal aconseguir que només destruïsquen cèl·lules canceroses o comprovar fins a quin punt l’efecte residual sobre cèl·lules no tumorals és tolerable per l’organisme, a més de confirmar que la necrosi ocorre i és selectiva també dins d’organismes complets molt més complexos que les cèl·lules en cultiu. I també seria interessant que els nanotrepants es pogueren activar amb un altre tipus d’interruptor que no siga danyós per a les cèl·lules.
Al mateix temps, els nanotrepants obrin un ventall d’excitants possibilitats: es podran utilitzar altres codis postals per a poder dirigir els nanotrepants contra altres tipus de càncer? I contra una trombosi circulatòria, com en el Xip prodigiós? Bé, potser açò serà més difícil, perquè les trombosis no sols contenen cèl·lules que puguen destruir-se foradant-ne la membrana. Però la imaginació no té límits; tampoc la dels científics. El temps dirà si aquestes o altres màquines moleculars poden o no encarregar-se de complir totes les sorprenents profecies dels grans clàssics de la ciència-ficció.
Referència:
Molecular machines open cell membranes (2017). García-López V., Chen F., Nilewski L. G., Duret G., Aliyan A., Kolomeisky A. B., Robinson J. T., Wang G., Pal R., Tour J. M. Nature, 548(7669):567-572. doi: 10.1038/nature23657
https://www.nature.com/nature/journal/v548/n7669/full/nature23657.html





[…] Sigue leyendo en Conec.es […]