
Comer lo que te dé la gana y no engordar, ¿a quién no le gustaría? Aunque sólo sea porque nos arruine la operación bikini, ya sabemos que abusar de las grasas en nuestra dieta no nos hace bien. Pero llegar a tener sobrepeso u obesidad tiene otras muchas consecuencias negativas en nuestro organismo, aunque no sean tan fáciles de detectar a simple vista como un michelín.
Por ejemplo, ser obeso hace que aumente la probabilidad de que padezcamos diabetes, hipertensión, hígado graso o incluso algunos tipos de cáncer, entre otras enfermedades. A pesar de ello, el número de personas con sobrepeso u obesidad ha aumentado de manera dramática durante las últimas décadas, debido principalmente a nuestro modo de vida sedentario y a nuestra alimentación. Por todo ello, en nuestro laboratorio estamos interesados en prevenir las consecuencias nocivas asociadas a la obesidad – y quizá hayamos encontrado una manera de combatir algunas de ellas: disminuyendo los niveles de GRK2.
¿Qué es GRK2? Es una proteína que tenemos en todas las células de nuestro organismo, conocida por fosforilar (modificar) ciertos receptores celulares para desensibilizarlos. Además, estudios previos relacionaron a esta proteína con la insulina: GRK2 atenuaría los efectos que tiene la insulina en nuestras células, ya que interacciona y así secuestra a otra proteína necesaria para que la insulina funcione correctamente. ¿Por qué esto es importante en la obesidad? La insulina es una hormona que se encarga de regular el metabolismo. La pérdida de sensibilidad a insulina o insulino resistencia es la condición que se da cuando el cuerpo no responde a esta hormona, por lo que esta no ejerce sus efectos y el metabolismo deja de regularse adecuadamente.
La insulino resistencia es una de las consecuencias de la obesidad, y por la relación que acabamos de comentar, GRK2 podría estar contribuyendo a que se adquiriera.
Esto nos llevó a plantear la hipótesis de que disminuir los niveles de GRK2 podría ser beneficioso para atenuar la insulino resistencia provocada por la dieta, y así atenuar las consecuencias nocivas de la misma.
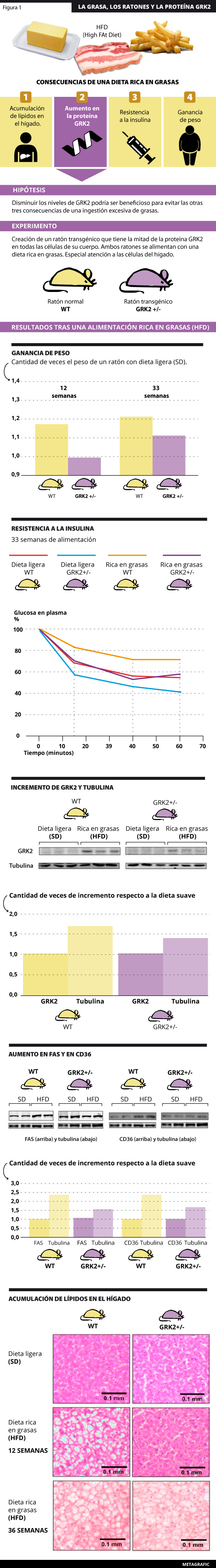
¿Cómo comprobamos esto? Por suerte para nosotros y por desgracia para ellos, los ratones no se libran de la obesidad: comprobamos que cuando se alimentan con una dieta alta en grasa, ganan más peso y adquieren insulino resistencia. Esto hace que podamos utilizarlos para el estudio de la obesidad. Centramos este estudio en el hígado, porque es un órgano clave en la regulación del metabolismo y porque otra de las consecuencias de esta dieta es la acumulación de grasa en el mismo, como también comprobamos. Además, observamos también que los niveles proteicos de GRK2 aumentaban en el hígado a consecuencia de la dieta.
Para comprobar nuestra hipótesis y ver si GRK2 estaba teniendo algo que ver en la aparición de estas consecuencias, creamos un ratón transgénico que poseía la mitad de GRK2 en todas las células de su cuerpo respecto a un ratón normal. Y, efectivamente, vimos que estos ratones transgénicos no ganaban tanto peso con la dieta, ni perdían la sensibilidad a insulina, ni acumulaban grasa en el hígado.
Además, mantenían los niveles de GRK2 estables a pesar de la dieta alta en grasa.
Sin embargo, estos efectos protectores se perdían cuando la dieta se prolongaba hasta 33 semanas en lugar de 12: a largo plazo, sí que aumentaba GRK2 también en estos ratones, y comenzaban a ganar peso, volverse insulino resistentes y presentar acumulación de grasa en el hígado.
Para estudiar a qué se debía la acumulación o no de grasa en el hígado que estábamos observando en las distintas condiciones, estudiamos los niveles de algunas proteínas clave en el metabolismo de lípidos en el hígado, lo cual puede indicarnos el flujo de ciertos procesos metabólicos. Observamos una buena correlación entre los niveles de FAS, proteína encargada de sintetizar lípidos de novo, y el grado de acumulación de lípidos en el hígado. Lo mismo ocurría con CD36, proteína encargada de introducir ácidos grasos al interior celular. Esto nos indica que la acumulación de grasa observada se puede deber a que las células hepáticas sintetizan más lípidos y captan más ácidos grasos de la sangre. Sorprendentemente, también observamos un aumento en otra proteína llamada HADHA, lo que indicaría que las células estarían oxidando (consumiendo) más ácidos grasos. Esto no cuadra con los resultados que venimos comentando. Sin embargo, hay que tener en cuenta que este proceso, en condiciones como las que produce la dieta alta en grasa, puede estar inhibido a través de otros mecanismos, por lo que, aunque aumente HADHA, puede no estarse produciendo un aumento en la oxidación de lípidos.
Fig. 1. Se muestran las consecuencias encontradas al alimentar a los ratones normales (WT) y transgénicos (GRK2+/-) con una dieta alta en grasa. Estas se pueden resumir en: aumento de peso, desarrollo de resistencia a la insulina, aumento en la acumulación de lípidos en el hígado (debido al aumento en FAS y CD36) e incremento en los niveles de GRK2 en el hígado. Una dieta alta en grasa hace que los ratones normales presenten características patológicas, pero los ratones GRK2+/- están protegidos de este efecto sólo cuando dicha dieta dura 12 semanas, pero no cuando dura 33. Esto indica que la dieta alta en grasa aumentaría los niveles de GRK2, y cuando llegaran a cierto umbral, GRK2 contribuiría o agravaría las consecuencias patológicas de la dieta.
En resumen, la dieta alta en grasa no hace bien al organismo, y hace que aumenten los niveles de GRK2, una proteína que a su vez contribuye o agrava las consecuencias negativas de esta dieta. La pescadilla que se muerde la cola. Tener menos niveles de GRK2 hace que la dieta alta en grasa sea menos mala, pero sólo cuando no se prolonga demasiado tiempo. En este último caso, a pesar de ser un transgénico que expresa la mitad de GRK2 y por ello estar protegido de los efectos nocivos de la grasa, los niveles de esta proteína empiezan a aumentar, por lo que se pierde este estado de protección.
Deducimos de este estudio la importancia de utilizar modelos científicos adecuados cuando estamos estudiando patologías humanas: el modelo de 33 semanas es más parecido a lo que ocurriría en humanos obesos, y vemos que molecularmente no es igual estar 12 semanas que 33 comiendo grasa. Porque, por ejemplo, no observamos un aumento de GRK2 en nuestros ratones transgénicos a las 12 semanas, pero sí a las 33.
Y lo más importante: de este estudio concluimos que disminuir o quizá inactivar a GRK2 podría utilizarse como estrategia para prevenir las patologías derivadas de una dieta alta en grasa. Pero hasta que esta teoría llegue a validarse y se desarrollen fármacos contra GRK2, mejor dejar de atiborrarse a patatas fritas y hamburguesas. Tu hígado te lo agradecerá.

AUTORA
Irene Herranz Montoya
Accésit del Jurado al trabajo: “Efecto de GRK2 en la esteatosis hepática en modelo murinos de
obesidad inducida por dieta alta en grasa a medio y largo plazo: consecuencias fisiopatológicas”. Universidad Autónoma de Madrid. Tutor: Federico Mayor Menéndez.
+INFO CERTAMEN ARQUÍMEDES
Web del certamen | Facebook






No comments yet.